以我校生物科技與大健康學院�、廣東省醫(yī)學大動物模型重點實驗室干細胞與再生醫(yī)學領域鄭允文教授團隊和范江霖教授團隊為核心研發(fā)成員���,與日本筑波大學���、中科院分子細胞科學卓越創(chuàng)新中心等單位合作���,以我校引進高層次人才葛劍云博士為共同一作�����,近日在Advanced Science雜志發(fā)表了題為Survival-Assured Liver Injury Pre-Conditioning (SALIC) enables robust expansion of human hepatocytes in Fah-/-Rag2-/-IL2rg-/-rats的研究論文,創(chuàng)建了世界首個超過30%人源化肝臟嵌合率并具有人型藥物代謝特征的大鼠,為臨床新藥開發(fā)和疾病建模提供新的動物模型選擇���,有望引領藥物研發(fā)的新紀元。
該研究團隊利用CRISPR/Cas9技術構(gòu)建了FRG大鼠,開發(fā)了一套控制慢性肝損傷的NTBC循環(huán)模式SALIC���,能夠在確保較高長期存活率的前提下維持慢性肝損傷����,促進供體人肝細胞移植后在大鼠肝臟內(nèi)實現(xiàn)可持續(xù)增殖。進一步地����,研究團隊以抗病毒藥物齊多夫定(zidovudine)作為研究對象�����,測試了Ⅱ相代謝酶尿苷二磷酸葡萄糖醛酸轉(zhuǎn)移酶2B7(UGT2B7)活性,證實了人源化大鼠有別于普通大鼠肝臟�,具有人肝特有的體內(nèi)代謝特征�����。隨著移植置換率的改進與提高,人源化周期的縮短�����,其在藥物研發(fā)����、產(chǎn)業(yè)化應用和臨床研究中的價值將會帶來新的變革浪潮。
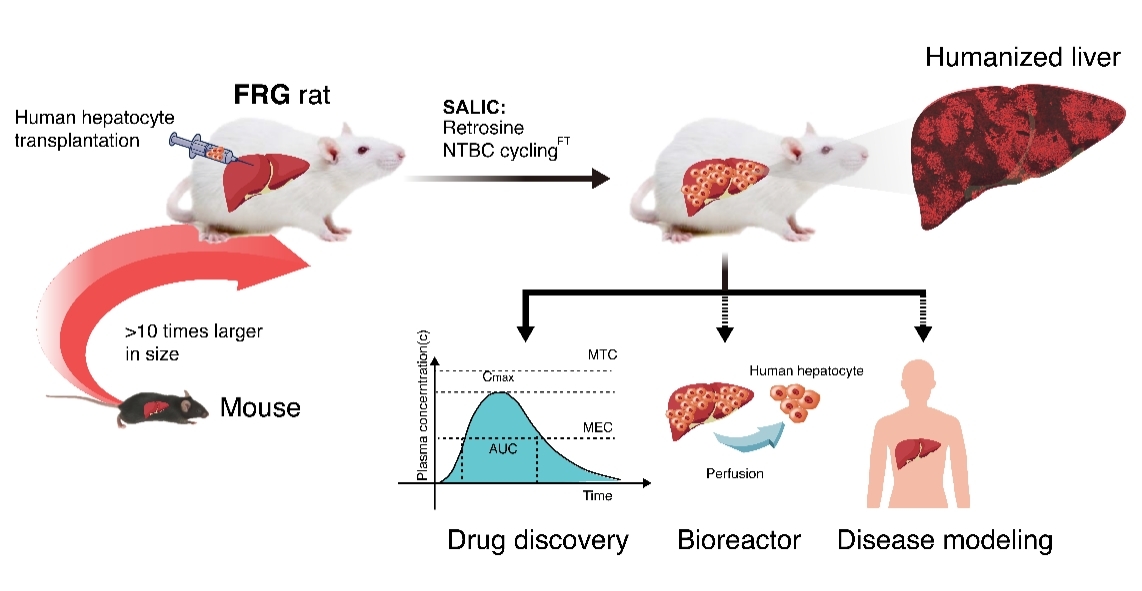
近年來��,以人源化血液和肝臟為主流的小鼠模型成為醫(yī)學��、藥學及產(chǎn)業(yè)化領域的研究熱點�����,有望成為闡明人類疾病發(fā)生機制、推動新藥研發(fā)的重要臨床前研究模型���。然而小鼠模型在應用上存在諸多局限�,大鼠作為一種更適合藥物和臨床前研究的嚙齒類動物模型,在體型上比小鼠大十倍,更易于手術、采樣與藥物代謝動態(tài)觀察����。開發(fā)人源化的大鼠模型不僅可以推動藥物研發(fā)的進程�,也是未來開發(fā)人源化大動物模型的重要過渡和必要橋梁。

(文/生物科技與大健康學院)

